
Die giftigen Inhaltsstoffen der Pflanzen werden in verschiedene Klassen eingeteilt, die in erster Linie auf chemischen Unterschieden beruhen. Oft ist es aber auch so, daß in bestimmten Pflanzenfamilien bevorzugt auch bestimmte Klassen von Inhaltsstoffen auftreten. Dies muß aber keineswegs immer der Fall sein. Im folgenden möchte ich die wichtigsten Klassen kurz vorstellen:

Ätherische Öle sind flüchtige Pflanzeninhaltsstoffe, die auch den Geruch einer Pflanze prägen. Ätherische Öle sind wichtige Bestandteile von Parfums; für das Aroma zahlreicher Kräuter und Gewürze sind sie ebenfalls verantwortlich, jedoch besitzen einige dieser ätherischen Öle eine ausgeprägte Giftigkeit.
Beim größten Teil der ätherischen Öle handelt es sich um sogenannte Isoprenoide. Das sind Verbindungen, deren Kohlenstoffgerüst sich formal in zwei (bei Monoterpenen) oder mehr (drei bei Sesqui-, vier bei Di- und sechs bei Triterpenen) Isopren-Einheiten zerlegen läßt, wobei die Di- und Triterpene allerdings kaum flüchtig sind. Pinen (u.a. aus der Kiefer Pinus sylvestris) und Thujon (u. a. aus dem Wermut Artemisia absinthium und dem Lebensbaum Thuja occidentalis) sind Beispiele für Monoterpene. Die beiden Isopreneinheiten sind in der Graphik durch unterschiedliche Farben hervorgehoben. Isopren selbst, eine Flüssigkeit, die bei 34 °C siedet, kommt nicht in Pflanzen vor.

Zu den bekanntesten Bestandteilen ätherischer Öle nicht isoprenoider Art gehört der für das typische Zimtaroma verantwortliche Zimtaldehyd, das schwach toxische Cumarin des Waldmeisters (Galium odoratum) aber auch die Furocumarine, die für die phototoxischen Eigenschaften verschiedener Doldenblütengewächse (Apiaceae) verantwortlich sind (z.B. das Imperatorin). Obwohl Cumarin und Imperatorin schon Feststoffe sind und somit im eigentlichen Sinne keine Öle mehr, ist es aufgrund ihrer großen Flüchtigkeit dennoch gerechtfertigt, sie in diese Kategorie einzustufen.

Die Alkaloide stellen die wichtigste Klasse von giftigen Pflanzeninhaltsstoffen dar. Dabei ist die Definition des Begriffes »Alkaloid« alles andere als eindeutig. In jedem Falle enthalten Alkaloide Stickstoff, der so im Molekül gebunden ist, daß er mit Säuren Salze bilden kann (wie lackmusbläuende Alkalien - daher der Name Alkaloide = Alkalienähnliche) und zumeist in einem Ring sitzt (nicht z.B. im Mescalin). Die Alkaloide werden nach im Molekül befindlichen Grundstrukturen eingeteilt:
| Gruppe | Grundkörper | Beispiel | Bezeichnung Vorkommen |
Chinolizidin-Alkaloide |
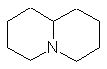 |
 |
Cytisin |
Indol-Alkaloide |
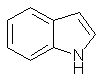 |
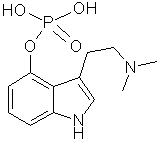 |
Psilocybin Spitzkegeliger Kahlkopf (Psilocybe semilanceata) |
Isochinolin-Alkaloide |
 |
 |
Chelidonin Schöllkraut (Chelidonium majus) |
Phenethylamin-Alkaloide |
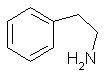 |
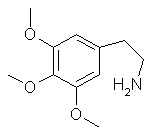 |
Mescalin Peyotl-Kaktus (Lophophora williamsii) |
Piperidin-Alkaloide |
 |
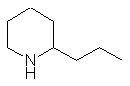 |
Coniin Gefeckter Schierling (Conium maculatum) |
Steroid-Alkaloide |
diverse Grundkörper (vgl. auch Saponine) |
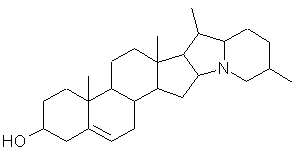 |
Solanidin Kartoffel (Solanum tuberosum) |
Tropan-Alkaloide |
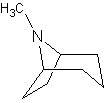 |
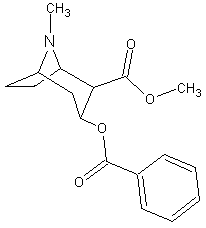 |
Cocain Coca-Strauch (Erythroxylum coca) |
Aminosäuren sind als Bausteine der Eiweißstoffe (Proteine) lebensnotwendig für alle Organismen. Aminosäuren sind aber ebenfalls Bausteine der Alkaloide. Des weiteren können Aminosäuren durch Abspaltung von Kohlendioxid in sogenannte biogene Amine übergehen: Aus Tryptophan entsteht dann z.B. Tryptamin und aus Histidin das berüchtigte Histamin, welches unter anderem in verdorbenem Fisch vorkommt. Neben diesen toxischen Aufbau- respektive Abbauprodukten der Aminosäuren, gibt es auch einige wenige Aminosäuren, die selbst giftig sind. Ein Beispiel hierfür ist die Ibotensäure, der Giftstoff des Fliegenpilzes (Amanita muscaria):
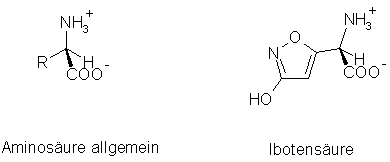
Glykoside sind Moleküle, bei denen ein Molekülteil (das sogenannte Aglykon) chemisch mit einem oder mehreren Zuckermolekülen verbunden ist. Der eigentliche Träger der Giftwirkung ist das Aglykon, dennoch sind die gebundenen Zuckermoleküle nicht unerheblich für die Giftigkeit. Zucker (egal ob Traubenzucker, Fruchtzucker oder ein anderer) löst sich bekanntermaßen sehr gut in Wassser. Der chemisch gebundene Zucker bewirkt nun, daß sich das Glykosid besser in wässrigen Flüssigkeiten (z.B. Blut) löst als das reine Aglykon und somit besser vom Organismus aufgenommen (resorbiert) werden kann. Entsprechend erhöht sich auch die Giftigkeit. Die wichtigsten Glykoside:
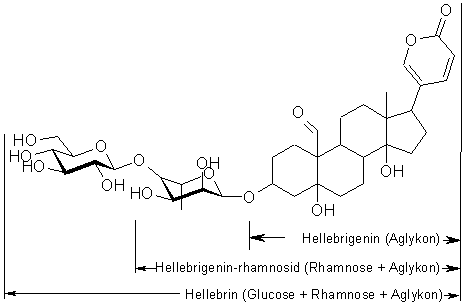
Bufadienolide wurden zuerst im Sekret von Erdkröten (Bufo
bufo)
gefunden. Auch im Pflanzenreich sind Bufadienolide weit verbreitet,
z.B.
das Hellebrin in der Christrose
(Helleborus
niger).
Bufadienolide
sind sämtlich Herzgifte und dürfen nicht mit dem
Bufotenin
(Formel unter Phalaris arundinacea)
verwechselt
werden, einer Substanz, die mehr dem Psilocybin bzw. dem
körpereigenen
Serotonin (Formel unter Urtica
dioica)
ähnelt und eine halluzinogene Wirkung hat. Das
hier
als Beispiel abgebildete Hellebrin setzt sich aus dem Aglykon
Hellebrigenin,
L-Rhamnose (ein Zucker der häufig in solchen Glykosiden
eingebaut
ist)
und Glucose (Traubenzucker) zusammen.
Cardenolide sind strukturell eng verwandt mit den Bufadienoliden und
(wie
aus dem Namen schon zu vermuten ist) ebenfalls Herzgifte. Beide Gruppen
werden
als Herzglykoside zusammengefasst und sind aus der modernen Medizin
nicht
mehr wegzudenken. Eine besonders große Bedeutung kommt
hierbei
den
Fingerhut-Glykosiden (insbesondere denen des Wolligen Fingerhutes
Digitalis
lanata)
zu. Als
Beispiel
habe ich jedoch die Glykoside des Maiglöckchens
(Convallaria
majalis)
ausgewählt, die den Glykosiden aus der Christrose sehr
ähnlich
sind. Der einzige Unterschied besteht im sogenannten Lacton-Ring
(jeweils
rechts oben in den Abbildungen) und eben dieser Lacton-Ring ist es, der
den
Unterschied zwischen Bufadienoliden und Cardenoliden beschreibt.

Mit anderen Zuckern verknüpft, befindet sich das Aglykon k-Strophantidin auch in der afrikanischen Liane Strophantus kombe. Das betreffende Glykosid wird als k-Strophantin bezeichnet.
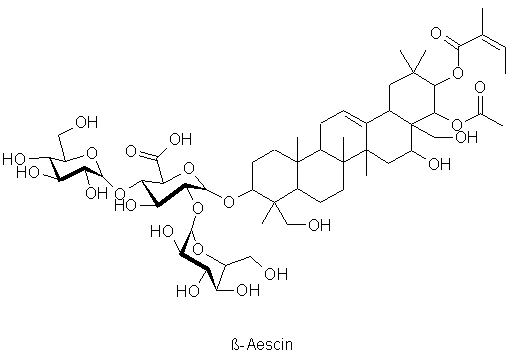
Der Name Saponine leitet sich von »saponis«, dem
lateinischen Wort
für Seife ab. Ähnlich der Seife und den oben
aufgeführten
Herzglykosiden, besitzen auch Saponine einen Molekülteil, der
sich
gut
in Fett löst (das Aglykon) und einen der sich gut in Wasser
löst
(der Zuckerrest). Damit kann die Oberflächenspannung von
Wasser
erniedrigt
werden (wie dies auch beim Zusatz von Waschmitteln passiert), was sich
unter
anderem durch eine Schaumbildung bemerkbar macht. Die Schaumbildung
durch
Saponine ist z.B. gut zu beobachten, wenn an einem regenreichen
Herbsttag
ein Gemenge von Regenwasser und von durch Autoreifen zerquetschten
Roßkastanien über die Straße rinnt.
Saponine sind
zumeist
sehr giftig für Fische. Im menschlichen Organismus
führt die
Erniedrigung der Oberflächenspannung zu einer
Beschädigung
der
Zellmembram. Dies ist die Ursache der sogenannten
hämolytischen
Wirkung:
Hierbei kann der rote Blutfarbstoff (Hämoglobin) aus der Zelle
austreten
(Hämolyse). Saponine, die im Aglykon Stickstoff enthalten,
werden
als
Steroidalkaloide bezeichnet. Das Saponin der Roßkastanie
(Aesculus
hippocastanum)
ß-Aescin weist eine Besonderheit auf: In die Zuckerkette ist
Glucuronsäure eingebaut, eine Verbindung, die auch von unserer
Leber
aus Glucose (Traubenzucker) gebildet wird.
Oberflächenspannung:
Ist z.B.
dafür
verantwortlich, daß eine vorsichtig aufs Wasser gelegte
Büroklammer
nicht untergeht, obwohl Eisen ja schwerer als Wasser ist. Das
Hinzufügen
von Spülmittel bewirkt, daß sie dann nach einiger
Zeit doch
zu
Boden sinkt.
In den cyanogenen Glykosiden ist Blausäure (Cyanwasserstoff)
chemisch
gebunden. Diese Blausäure kann durch Einwirkung bestimmter
Enzyme
wieder
freigesetzt werden. Blausäure ist sehr giftig und unter
anderem
auch
für die Giftigkeit von Natriumcyanid und Kaliumcyanid
(Zyankali)
verantwortlich. Dem ein oder anderen dürfte bekannt sein,
daß
Blausäure z.B. aus Bitteren Mandeln
(Prunus
dulcis var. amara)
freigesetzt
werden kann, aber auch die anderen Rosengewächse, etwa unser
Steinobst
(Prunoidae),
enthalten in den
Samenkernen
mehr oder weniger große Mengen des cyanogenen Glykosides
Amygdalin.
Für das typische Bittermandelaroma ist übrigens der
Benzaldehyd
verantwortlich, eine ungiftige Chemikalie, die auch industriell
für
alle möglichen Zwecke hergestellt wird. Im folgenden kleinen
Schema
ist dargelegt, wie Amygdalin unter der Einwirkung von Wasser und
Enzymen
gespalten wird:

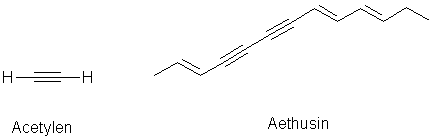
Acetylen (Ethin), das ehemals in gelben, mittlerweile in braunen Stahlflaschen gelieferte Gas zum autogenen Schweißen, ist der Grundkörper der Polyine. Polyine, die natürlich nicht mehr gasförmig sondern zumeist Feststoffe sind, befinden sich überwiegend in Doldenblütengewächsen (Apiaceae). Ein Beispiel ist das Aethusin der Hundspetersilie (Aethusa cynapium).
Proteine entstehen durch chemisches Verknüpfen von Aminosäuren (bei weniger als 1000 Aminosäuren spricht man nicht mehr von Proteinen sondern von Peptiden) und sind als Eiweiß unverzichtbar für unsere Ernährung. Allerdings gehört auch das stärkste bisher bekannte Gift (siehe »Über Gifte«) Botulinustoxin (gebildet als Stoffwechselprodukt der Bakterien Clostridium botulinum), das von Schönheitschirurgen zu Botox verniedlicht wurde, zu den Proteinen. Unter den Tiergiften sind solche giftigen Proteine weit verbreitet (z.B. Bienengift, Wespengift, Schlangengifte). Es gibt aber auch Pflanzen, die giftige Proteine enthalten. Ein Beispiel hierfür ist das Ricin aus der Rizinusstaude (Ricinus communis), aber auch die Gartenbohne (Phaseolus vulgaris) enthält mit dem Phasin eine solche Substanz. Es ist keineswegs so, daß giftige Proteine giftige Aminosäuren enthalten. Vielmehr ist es die räumliche Anordnung der Aminosäuren, die für die Giftigkeit verantwortlich zeichnet. Allen diesen Proteinen ist gemeinsam, daß sie durch Erhitzen (Denaturierung) ihre Giftigkeit verlieren, weshalb gekochte Bohnen ungiftig sind.
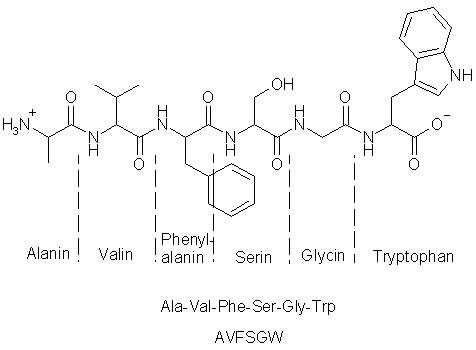
Das abgebildete Peptid besteht gerademal aus sechs Aminosäuren. Man kann sich leicht vorstellen, wie unübersichtlich eine solche Formel mit 1000 und mehr Aminosäuren aussehen würde. Deshalb bevorzugt man bei Peptiden andere, kürzere Schreibweisen, die darunter wiedergegeben sind. Während man bei Ala-Val-Phe-Ser-Gly-Trp noch in etwa den Namen der eingebauten Aminosäuren erkennen kann, ist dies bei der unteren Variante (AVFSGW) nicht unbedingt der Fall. Andererseits ist die Zuordnung der Buchstaben festgelegt und jeder kann anhand einer geeigneten Tabelle die betreffenden Aminosäuren ermitteln. Für größere Peptide ist diese Schreibweise allemal die geeignetere.
Bei der Beschreibung der giftigen Proteine wurde bereits festgestellt, daß die toxische Eigenschaft im wesentlichen von der räumlichen Struktur anhängig ist. Einen wesentlichen Einfluß auf die räumliche Struktur haben die beiden Aminosäuren Cystein und Cystin. Dies liegt an der Besonderheit, daß sich zwei Moleküle Cystein zu Cystin verbinden können und das entstehende Cystin somit in der Lage ist, zwei Peptidketten miteinander zu verknüpfen:

Die Bildung von Cystin aus zwei Cystein-Molekülen ist umkehrbar (reversibel). Diesen Vorgang nutzt z.B. Ihr Friseur aus, wenn er Ihnen eine Dauerwelle verpaßt. Zuerst wird das Cystin gespalten, dann das Haar gerollt und schließlich Cystin aus zwei Cystein-Molekülen, die vorher nicht benachbart waren, wieder neu geknüpft und so die Dauerwelle fixiert. Zwei Peptidketten, die durch ein Cystein miteinander verknüpft sind, zeigt der untere Teil der Abbildung. Cystin prägt auch im wesentlichen die Eigenschaften der Kleberproteine (Glutene), die im Getreide und hier insbesondere im Weizen vorkommen. Ohne Kleberproteine würde sich kein luftiges Brot backen lassen sondern jedes Brot (auch Weißbrot) hätte in etwa die Konsistenz von Pumpernickel. Eine Tabelle der giftigen Nahrungspflanzen finden Sie im entsprechenden Themenverzeichnis.